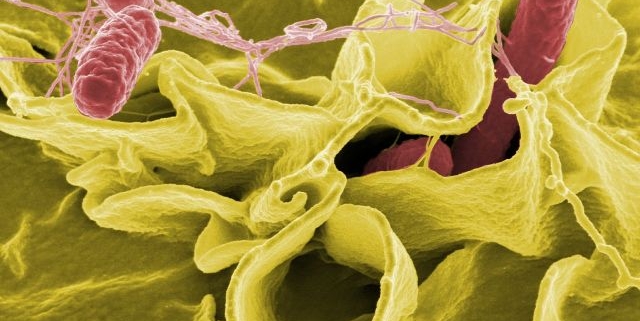
Dieses Gen lässt Salmonellen resistent gegen alle Antibiotika werden
„Antibiotika waren zweifelsohne eine der wichtigsten medizinischen Entwicklungen des 20. Jahrhunderts. Gleichzeitig entwickeln sie sich aber zu einer der großen Herausforderungen des 21. Jahrhunderts. Dank einer sehr lockeren Verschreibungspraxis bei menschlichen Patienten sowie einer extensiven Nutzung von Antibiotika in der Tierzucht grassieren inzwischen weltweit – vor allem in den medizinisch ausgezeichnet versorgten Industriestaaten – sogenannte multiresistente Bakterien. Dabei handelt es sich um Erreger, die gegen viele Antibiotika immun sind. In den USA wurde nun erstmals ein bakterielles Gen gefunden, das eine Resistenz gegen die sogenannten „Last Resort“-Antibiotika verleiht, also gegen die wirksamsten und stärksten existenten Antibiotika.
Salmonellen sind Bakterien, die mit Lebensmittelvergiftungen assoziiert sind. Im Normalfall ist eine Salmonelleninfektion in der Regel eine Frage der Geduld – irgendwann verschwindet sie wieder. Nicht gefährlich, aber unangenehm. Anders sieht es bei besonders jungen oder alten Menschen sowie Menschen mit geschwächtem Immunsystem aus. Für sie können Salmonelleninfektionen ein Risiko sein, weshalb häufig Antibiotika verschrieben werden.
Und hier kommen wir zu einem Problem: Wie viele andere Bakterien haben auch Salmonellen eine Resistenz gegen die meisten Antibiotika entwickelt. Genauer gesagt gegen so ziemlich alle außer Colistin, ein Antibiotikum, das nun als letzte medikamentöse Behandlungsmöglichkeit von Salmonelleninfektionen gilt. Und nun sieht es so aus, als würde auch dieses Medikament nicht mehr lange wirken. Forscher in den USA haben ein Gen entdeckt, das Salmonellen die Fähigkeit verleiht, sich gegen Colistin zu wehren. Das Bakterium ist damit quasi nicht mehr mit Antibiotika behandelbar.
Gen kommt aus China
Das Gen ist als mcr-3.1 bekannt und befand sich bereits seit Jahren auf der Watchlist vieler Wissenschaftler. Nun scheint es erstmals in den USA aufgetreten zu sein.
„ Public health officials have known about this gene for some time. In 2015, they saw that mcr-3.1 had moved from a chromosome to a plasmid in China, which paves the way for the gene to be transmitted between organisms. For example, E. coli and Salmonella are in the same family, so once the gene is on a plasmid, that plasmid could move between the bacteria and they could transmit this gene to each other. Once mcr-3.1 jumped to the plasmid, it spread to 30 different countries, although not – as far as we knew – to the US„, so Siddhartha Thakur, einer der Autoren der Studie.
Das Gen wurde bei Routineuntersuchungen entdeckt, die dazu dienten, neue multiresistente Bakterienstränge zu entdecken. Das mcr-3.1 Gen wurde in einer Stuhlprobe entdeckt, die bereits 2014 von einem Patienten entnommen wurde, der in China eine Salmonellen-Infektion bekam. Theoretisch ist das Gen in der Lage, sich auf das deutlich gefährlichere Bakterium E.coli zu übertragen.
Die Verbreitung dieses Gens ist ein weiterer Schritt in Richtung superresistenter Bakterien. Allerdings werden stetig neue Antibiotika entwickelt, und auch an anderen Behandlungsmethoden für multiresistente Bakterien wird geforscht.“
Quelle: https://www.trendsderzukunft.de/medizin-dieses-gen-laesst-salmonellen-resistent-gegen-alle-antibiotika-werden/amp/