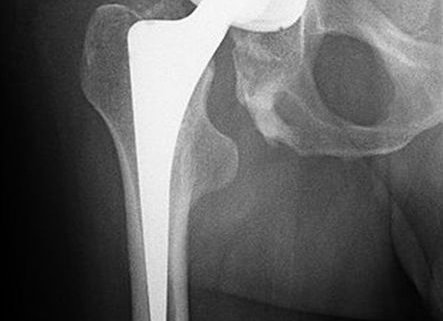
Bakteriophagen Therapie bei einer chronischen MRSA Gelenkprothesen Infektion
Dies ist der Fall eines 72-jährigen Mannes mit einer chronischen Methicillin-resistenten Staphylococcus aureus-Gelenkprothesen Infektion. Nach der dritten intravenösen Bakteriophagen-Therapiedosis führte eine ungewöhnliche, reversible Transaminitis zum Abbruch der Bakteriophagen-Therapie. Dennoch war die Behandlung erfolgreich, und die schwere chronische Infektion des Patienten wurde ausgerottet.
Nach den Erkenntnissen dieses Forscherteams ist dies der erste Fall einer Bakteriophagentherapie, die erfolgreich als adjuvante Therapie zur Heilung eines chronischen MRSA-PJI eingesetzt wird. Über zwei weitere erfolgreiche Bakteriophagenbehandlungen von MSSA und Pseudomonas PJI wurde berichtet [10,11]. Einzigartig an unserem Fall ist, dass keine chronischen Suppressionsantibiotika eingesetzt wurden. Es ist wenig über die optimale Behandlungsdauer oder die Verabreichungswege bei PJI bekannt. Es war geplant, länger zu behandeln, aber die Therapie wurde gestoppt, als eine signifikante Transaminitis auftrat. Trotzdem wurde eine erfolgreiche Sterilisation des Gelenks und des devitalisierten Knochens des Patienten mit einer IA und einer 3-tägigen IV-Bakteriophagentherapie in Kombination mit Standardtherapie-IV-Antibiotika über 6 Wochen erreicht. Angesichts der Fähigkeit der Bakteriophagen, sich selbst zu vermehren, sind als Ergänzung zum chirurgischen Débridement vielleicht nur wenige Tage Bakteriophagentherapie erforderlich. Klinische Studien sind erforderlich, um eine angemessene Dauer der Bakteriophagentherapie unter diesen Bedingungen zu bestimmen [10,11].
Bisher war bei allen PJI-Patienten, die erfolgreich mit Bakteriophagen behandelt wurden, ein chirurgisches Débridement erforderlich [10,11]. Diese Operation ermöglicht ein manuelles Abschrubben des Biofilms, stellt sicher, dass die Prothese verkaufsfähig ist, und ermöglicht die Instillation von Bakteriophagen direkt auf den Biofilm. Die lokale Dosierung von Bakteriophagen kann für die Beseitigung von Biofilminfektionen lebenswichtig sein, aber es liegen nur begrenzte Daten über Fallberichte hinaus vor [10,11,12]. Bei wiederholten IA-Dosen traten keine unerwünschten Ereignisse auf, was möglicherweise auf eine begrenzte systemische Absorption zurückzuführen ist. Zukünftige Studien müssen durchgeführt werden, um geeignete Verabreichungswege bei PJI zu bestimmen.
Der einzigartigste Aspekt unseres Falles war die Transaminitis, die nach der dritten IV-Bakteriophagendosis auftrat. Diese schien durch die Bakteriophagentherapie verursacht worden zu sein. Es wurde keine andere Störung der Leberfunktion festgestellt, und die Transaminitis war reversibel und nicht lebensbedrohlich. Abbildung 2 zeigt die Leberfunktion im Verlauf der Bakteriophagentherapie.
Die Patientin hatte eine Hepatomegalie, aber eine nicht-alkoholische Fettlebererkrankung konnte röntgenologisch nicht nachgewiesen werden, und die Biopsie wurde verschoben. Über 99% der IV-Bakteriophagen-Therapie werden rasch durch Leber und Milz abgebaut [13,14,15]. Die Theorie dieses Forschungsteams besagt, dass die zugrunde liegende Steatose die Lebermakrophagen dazu veranlasste, eine dysregulierte lokale Zytokinreaktion auszulösen, wenn sie mit einer grossen Anzahl von Bakteriophagen konfrontiert wurden, die hepatisch gesäubert werden mussten. Diese lokale Reaktion könnte zu entzündlichen Veränderungen in den Hepatozyten geführt haben, die zu einem Anstieg von AST und ALT führten. Dies wird durch Studien unterstützt, die die Rolle der Lebermakrophagen bei der Steatose und in älteren Studien zur hepatischen Clearance von Bakteriophagen untersuchen [13,14,15]. Es ist nicht bekannt, ob nach Verabreichung von Bakteriophagen häufig leichte bis mäßige Erhöhungen der Leberenzymwerte auftreten. Darüber hinaus ist nicht bekannt, ob eine fortgesetzte IV-Bakteriophagengabe die Transaminitis verschlimmert oder zu einer Anpassung und Auflösung geführt hätte. Vorerst sollten intravenös verabreichte Bakteriophagen bei Patienten mit zugrunde liegender Leberpathologie mit Vorsicht eingesetzt und die Leberenzyme genau überwacht werden. Dieser Fall ist begrenzt, da wir die Zytokinreaktion unseres Patienten auf die Bakteriophagentherapie nicht untersucht haben. Zukünftige Studien sollten dieses Ansprechen evaluieren, um mehr über das normale Ansprechen menschlicher Zytokine auf die Bakteriophagentherapie zu erfahren.
Zusammenfassend lässt sich sagen, dass eine Bergung der Prothese des Patienten aufgrund einer schweren Knochenerosion nicht möglich war. Wir waren jedoch in der Lage, den schweren chronischen MRSA-PJI des Patienten mit einem einzigen virulenten Bakteriophagen zu sterilisieren, dem IA und IV drei Tage lang in Kombination mit IV-Antibiotika verabreicht wurden. Es sind weitere PJI-Studien erforderlich, um die optimale Dauer und Art der Verabreichung der Phagen festzulegen. Die Bakteriophagentherapie hat ein enormes Potenzial zur Heilung von PJI, aber es müssen klinische Studien der Phase 1 und 2 durchgeführt werden.
Übersetzt der Quelle:
https://www.mdpi.com/2079-6382/9/5/241/htm
Salvage Bacteriophage Therapy for a Chronic MRSA Prosthetic Joint Infection
by James B. Doub,*,Vincent Y. Ng, Aaron J. Johnson,Magdalena Slomka, Joseph Fackler, Bri’Anna Horne ,Michael J. Brownstein ,Matthew Henry,