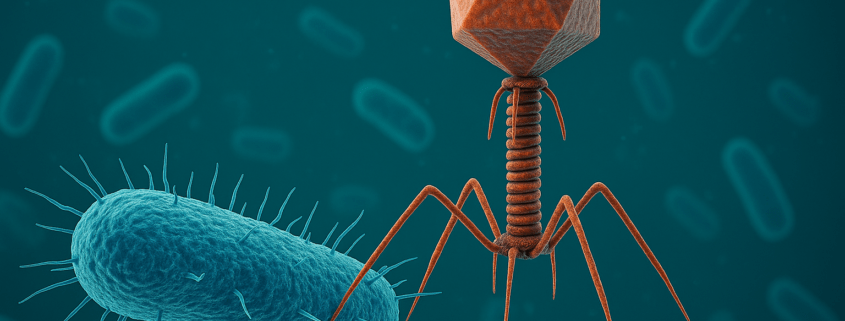
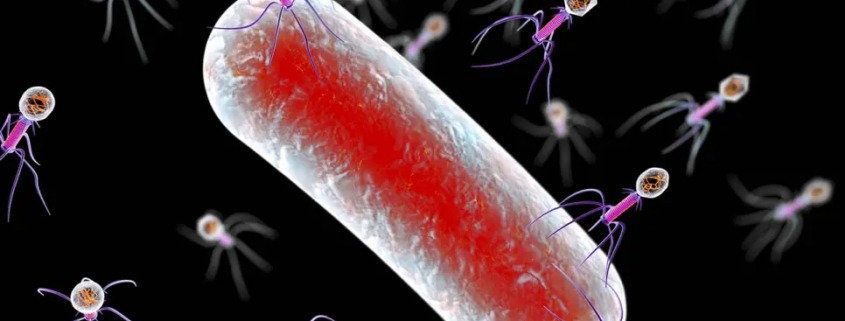
Studie: Phagen und Antibiotika: Eine wirksame Kombination gegen resistente Bakterien?
/in Allgemein /von OliverZusammenhang zwischen Darmbakterien und dem Risiko einer Krankenhausaufnahme aufgrund von Infektionskrankheiten
/in Allgemein /von OliverStudie: Einnahme von Bifidiobakterienhaltige Probiotika führt zu einer geringeren COVID-bedingten Krankenhausaufenthaltsdauer.
/in Allgemein /von OliverUnterstütze uns auf Facebook
HINWEIS: Phage.help behandelt eine Gesundheitsthema.
Verwenden Sie Informationen von Phage.help nicht als Grundlage für gesundheitsbezogene Entscheidungen und treffen Sie keine Selbstdiagnosen. Die Artikel auf Phage.help dienen der allgemeinen Information über ein Gesundheitsthema, nicht der Beratung im Falle individueller Anliegen.
Bei gesundheitlichen Beschwerden konsultieren Sie bitte Ihren Arzt oder Zahnarzt. Nur eine individuelle Untersuchung kann zu einer Diagnose und Therapieentscheidung führen.