Nierentransplantationspatient mit wiederkehrenden Infektionen bekommt virale Hilfe
Maria Madrigal wurde mit einer polyzystischen Nierenerkrankung geboren, obwohl sie bis zum Erwachsenenalter nicht wusste, dass sie diese Erbkrankheit hatte, als wachsende Zysten das Versagen der Organe verursachten. Zunächst half die Dialyse, doch schließlich benötigte Madrigal eine Spenderniere, die sie 2017 erhielt.
Vor der Nierentransplantation traten häufig wiederkehrende Infektionen auf. Nach der Transplantation kehrten sie zurück, aber dieses Mal war es schlimmer. Der invasive Erreger, ein Stamm von Escherichia coli, war multiresistent. Er ließ sich selbst mit den stärksten verfügbaren Antibiotika nicht behandeln.
„Mein Gesundheitszustand verschlechterte sich. Je mehr Antibiotika, desto schlimmer wurde es. Ich fühlte mich, als würde ich sterben“, sagte Madrigal.
„Ich habe (Maria) zum ersten Mal im November 2018 getroffen, als sie wegen einer Sepsis eingeliefert wurde und danach mehrmals mit einer wiederkehrenden Infektion“, sagte Saima Aslam, MBBS, Direktorin des Solid Organ Transplant Infectious Disease Service an der UC San Diego Health und Associate Professor of Medicine an der UC San Diego School of Medicine.
„Prognose in Bezug auf die Sterblichkeit ist schwer zu beurteilen, aber Sie hatte mehrere Krankenhausaufenthalte für das gleiche Problem und wurde auf fast kontinuierliche IV-Antibiotika – so sicherlich sehr schlechte Lebensqualität und Sie würde schließlich aus der Behandlung Optionen, die Erhöhung des Risikos zu sterben, von der multidrug-resistenten Infektion.“
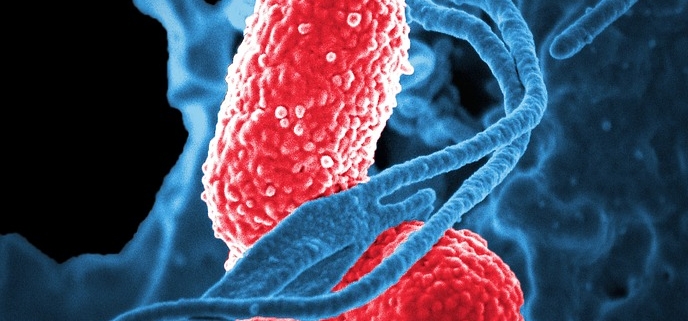
Phagen auf einer Zelle
Koloriertes Rastermikroskopbild einer Zelle, die von Phagen angegriffen wird.
Im Januar 2020 brachte Aslam die Idee der Bakteriophagen-Therapie ins Spiel. Bakteriophagen sind Viren, die gezielt Bakterien angreifen und abtöten. Aslam schlug vor, Madrigals hartnäckige und lebensbedrohliche Infektionen mit Phagen zu behandeln, eine aufstrebende Behandlungsmethode, die Forscher und Ärzte an der UC San Diego mit bemerkenswertem Erfolg entwickelt haben.
Tatsächlich befindet sich an der UC San Diego das Center for Innovative Phage Applications and Therapeutics (IPATH) , das erste dedizierte Phagentherapiezentrum in Nordamerika.
„Das Zentrum entstand zum Teil aus einer verzweifelten, lebensbedrohlichen Erfahrung mit meinem Mann“, sagt Steffanie Strathdee, PhD, eine Epidemiologin für Infektionskrankheiten, Professorin am Department of Medicine der UC San Diego School of Medicine und Co-Direktorin des IPATH.
„Er stand aufgrund einer systemischen bakteriellen Infektion, die allen anderen Behandlungen getrotzt hatte, am Rande des Todes. Eine experimentelle Phagentherapie, die von der FDA aus Mitleid genehmigt wurde, rettete schließlich sein Leben. Bei IPATH geht es darum, das therapeutische Potenzial von Phagen zu entwickeln und anderen Patienten zur Verfügung zu stellen, wenn herkömmliche Ansätze nicht funktionieren.“
Für jede Bakterienart auf der Erde gibt es einen Phagen, der sie angreift. Wie andere Viren können sich Phagen nicht selbst vermehren, sondern übernehmen die Vermehrungsmaschinerie von Bakterien. Sie tun dies, indem sie sich an ein Bakterium anheften und ihr genetisches Material einfügen, was einen Replikationsprozess in Gang setzt, der schließlich das Bakterium aufspaltet und neue Viruspartikel auf der Suche nach neuen Zielen ausspuckt.
Für Madrigal ginge es darum, die richtige Kombination von Phagen zu finden, um ihre spezifische bakterielle Infektion zu behandeln.
Das therapeutische Potenzial von Phagen ist nicht neu. Sie wurden in den 1920er und 30er Jahren als mögliche medizinische Behandlung erforscht, aber mit dem Aufkommen der Antibiotika weitgehend aufgegeben. Das wachsende globale Problem der bakteriellen Antibiotikaresistenz hat ihre Wiederauferstehung angeheizt.
Im Jahr 2016 setzte ein Team von Ärzten und Wissenschaftlern der UC San Diego Health eine experimentelle intravenöse Phagenbehandlung ein, um das Leben von Strathdees Ehemann zu retten: UC San Diego Professor Tom Patterson, der sich mit einem multiresistenten Stamm von Acinetobacter baumannii, einem opportunistischen und oft tödlichen Bakterium, infiziert hatte. Die Behandlung schlug an, und Patterson erholte sich.
Seit dem Fall Patterson haben Forscher des IPATH in Zusammenarbeit mit Ärzten der UC San Diego Health die Phagentherapie zur Behandlung mehrerer Fälle von Infektionen mit Antibiotikaresistenzen eingesetzt, darunter Patienten nach Organtransplantationen, mit zystischer Fibrose oder die implantierte medizinische Geräte verwenden.
In einer Arbeit, die am 27. August 2020 in der Zeitschrift Open Forum Infectious Diseases veröffentlicht wurde, beschreiben Aslam, Strathdee und Kollegen die ersten 10 aufeinanderfolgenden Fälle von intravenöser Phagentherapie. In sieben der 10 Fälle hatten die Patienten ein erfolgreiches Ergebnis.
Madrigals Fall ist die Nummer 11.
Sechs Wochen lang erhielt Madrigal zweimal täglich Infusionen mit einem am Baylor College of Medicine in Houston entwickelten Phagencocktail. Ihr Blutbild sowie ihre Leber- und Nierenfunktionen wurden regelmäßig überwacht, und sie erhielt weiterhin ein intravenöses Antibiotikum.
Nach einer Woche der Behandlung bemerkte Madrigal eine Verbesserung ihres Gesundheitszustandes. Ihr Appetit kehrte zurück. Sie konnte schneller laufen. „Ich wollte wieder aktiv sein.“
Madrigals Phagentherapie endete im August, als die Blutkulturen keine E. coli mehr anzeigten. Sie hörte auch auf, Antibiotika zu nehmen. Einige Fieberschübe und erhöhte Entzündungswerte haben die Ärzte dazu veranlasst, die Antibiotika-Kur wieder aufzunehmen (Aslam versucht, die Quelle des Fiebers ausfindig zu machen), aber ihre Bluttests sind weiterhin negativ für das Bakterium.
Aus Madrigals Sicht war die Phagentherapie eine unerwartete Rettungsleine: „Ich sah es als eine Alternative. Ich sagte mir: ‚Ich werde nichts verlieren, wenn ich es versuche. Im Gegenteil, ich könnte davon profitieren.‘ Ich tat es mit allem Glauben der Welt.
„Vor der Phagentherapie hatte ich das Gefühl, dass meine Zukunft ungewiss war. Eigentlich auch die Dialyse. Wenn man sich einer Dialyse unterzieht, gibt es immer Rückschläge. Es gibt Komplikationen. Es war ein langer Prozess, bis ich hierher kam. Ich habe viel durchgemacht, die Entfernung beider Nieren. Aber ich war immer sehr optimistisch, hatte großes Vertrauen in mich selbst und in das Team, das hinter mir steht. All das hat mir geholfen, dass es mir heute hier gut geht.“
Aslam sagte, das Interesse an der Verwendung von Phagen zur Behandlung von multiresistenten Organismen wachse. Andernorts sind Phagen-Zentren eröffnet worden. Von der Eröffnung des IPATH im Juni 2018 bis April 2020 haben die Ärzte und Wissenschaftler des Zentrums 785 Anfragen zur Phagentherapie von anderen Ärzten, Patienten und Familienmitgliedern von Patienten erhalten. Von diesen ausgewerteten Anfragen wurde in 119 Fällen eine Phagentherapie empfohlen, wobei die IPATH-Fakultät dabei hilft, die behandelnden Ärzte mit Phagenlaboren, Therapieplänen und Logistik zu verbinden. IPATH sammelt auch Geld, um eine Phagenbibliothek mit sorgfältig charakterisierten Phagen zu entwickeln, die zur schnelleren Behandlung von Patienten eingesetzt werden kann.
Aber Aslam gibt zu bedenken, dass dies noch ein Anfang ist: „Klinische Studien sind in Planung, um die Wirksamkeit wirklich wissenschaftlich zu bewerten“, sagt sie.
Übersetzung der Quelle: https://health.ucsd.edu/news/features/Pages/2020-12-02-one-for-the-phages.aspx
One for the Phages: Kidney Transplant Patient with Recurring Infections Gets Viral Help
By Yadira Galindo | December 01, 2020